Date: May 2020
Introduction
La lignée cellulaire BT-474 a une longue histoire, mais nous avons été nombreux à penser qu'elle arrivait en bout de course et commençait à devenir rapidement obsolète.
L'American Type Culture Collection (ATCC) rapporte que la lignée cellulaire BT-474 a été établie à l'origine en 1978 par E. Y. Lasfargues, qui avait pratiqué une biopsie tumorale sur une femme de 60 ans atteinte d'un carcinome canalaire du sein invasif à un stade avancé. La lignée cellulaire a ensuite été classée comme positive aux récepteurs aux œstrogènes (ER), aux récepteurs à la progestérone (PR) et aux récepteurs du facteur de croissance épidermique humain 2 (HER2) (1). Cette information a été essentielle pour établir un lien entre le modèle BT-474 utilisé dans la recherche préclinique sur le cancer du sein et de véritables patientes ayant le même profil génétique.
Selon l'American Association of Cancer Research, près de 80 % des patientes sont atteintes d'un cancer du sein à récepteurs d'œstrogènes positifs et environ 65 % d'entre elles à récepteurs de la progestérone positifs. Les patientes atteintes d'un cancer du sein à récepteurs aux œstrogènes et à la progestérone positifs sont plus susceptibles de répondre à l'hormonothérapie. Par ailleurs, environ 20 % du nombre total de cancers du sein présentent une augmentation du niveau d'expression de HER2, qui est liée à des tumeurs agressives et à croissance rapide. Le lien entre le modèle préclinique BT-474 et les biomarqueurs des patientes, associé à la nécessité de continuer à progresser dans le traitement du cancer du sein, a rendu ce modèle extrêmement souhaitable pour la recherche tant in vitro qu'in vivo.
Le défi du modèle BT-474
Tout ceci semblait trop beau pour être vrai, et ça l'était. Le problème avec le modèle BT-474 (et plusieurs autres modèles de cancer du sein) est qu'il est connu pour être difficile à utiliser in vivo.
Lorsqu'elle est implantée par voie sous-cutanée ou dans le coussinet adipeux mammaire de souris femelle « nude », la vitesse de croissance de la tumeur est extrêmement lente (le temps de doublement de la tumeur est > 20 jours) avec une variabilité importante de la croissance de la tumeur et des régressions tumorales spontanées. Ces résultats sont constants dans plusieurs études malgré les tentatives d'ajustement de multiples variables telles que la souche de la souris (SCID ou nude), le matériau d'implant (fragments ou cellules de tumeur), les compléments d'implant cellulaire (Matrigel® ou couche nourricière du cerveau) et le complément hormonal (estradiol).
En raison de ces problèmes, il est très difficile de travailler avec le modèle BT-474, en effet, les scientifiques et les chercheurs doivent souvent trouver d'autres modèles présentant des profils génétiques similaires, plus faciles à utiliser et pouvant produire des données plus fiables.
Cependant, comme il existe très peu de modèles qui répondent à tous les critères de la méthode BT-474 (carcinome du sein humain positif aux récepteurs aux œstrogènes, à la progestérone et du HER2+), nous avons décidé de mener des travaux supplémentaires pour continuer à optimiser le modèle. De plus, les progrès et l'accès aux souris NSG nous permettent d'évaluer la croissance du BT-474 dans cette souche la plus immunodéficiente.
Analyse
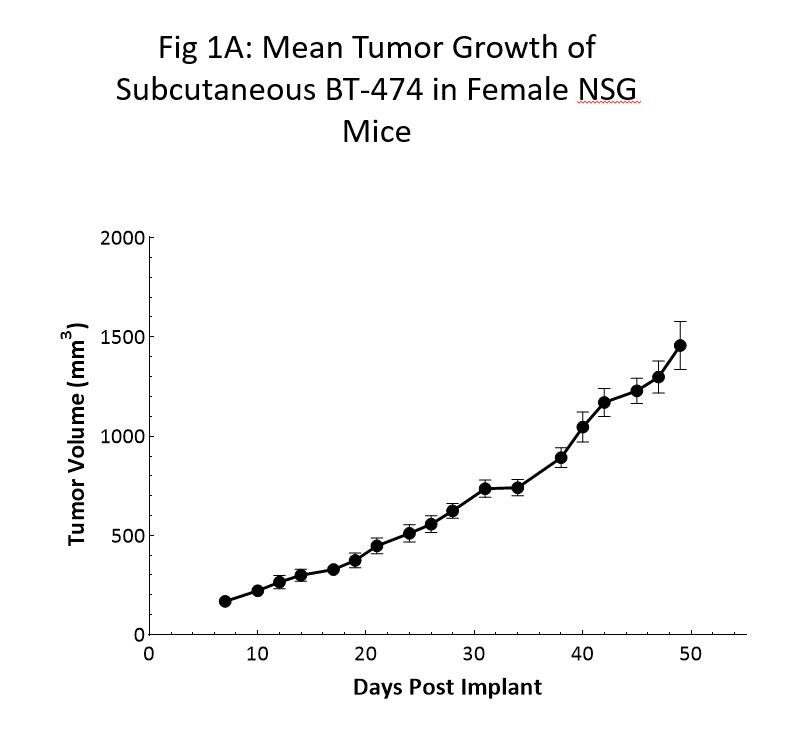
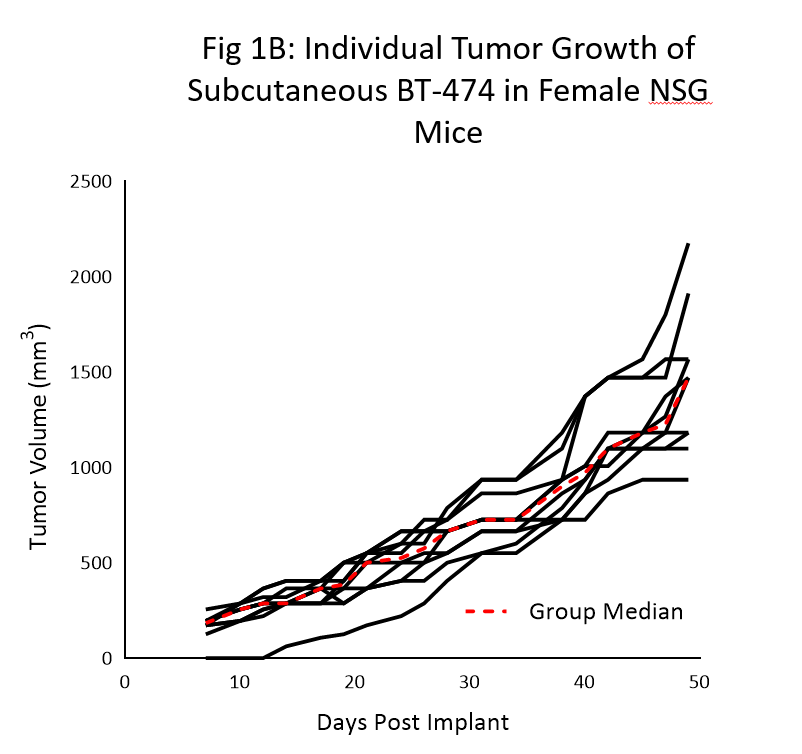
La cinétique de la croissance des tumeurs pour le modèle BT-474 chez les souris NSG est illustrée à la figure 1. Le temps de doublement moyen est d'environ 12 jours avec une augmentation constante du volume de la tumeur sans perte de poids corporel apparente liée à la tumeur (données non présentées). Le délai jusqu'à 150 mm3 (tumeurs établies) était de 7 jours après la pose de l'implant et le délai jusqu'à 1000 mm3 (taille d'évaluation) était de 40 jours après la pose de l'implant.
Des données cinétiques de croissance similaires ont été reproduites dans une série d'études au cours des 6 derniers mois.
Comme le montrent clairement les données, l'utilisation de la souris NSG a été déterminante pour la croissance fiable et reproductible de ce modèle.
Réponse au traitement ciblé HER2
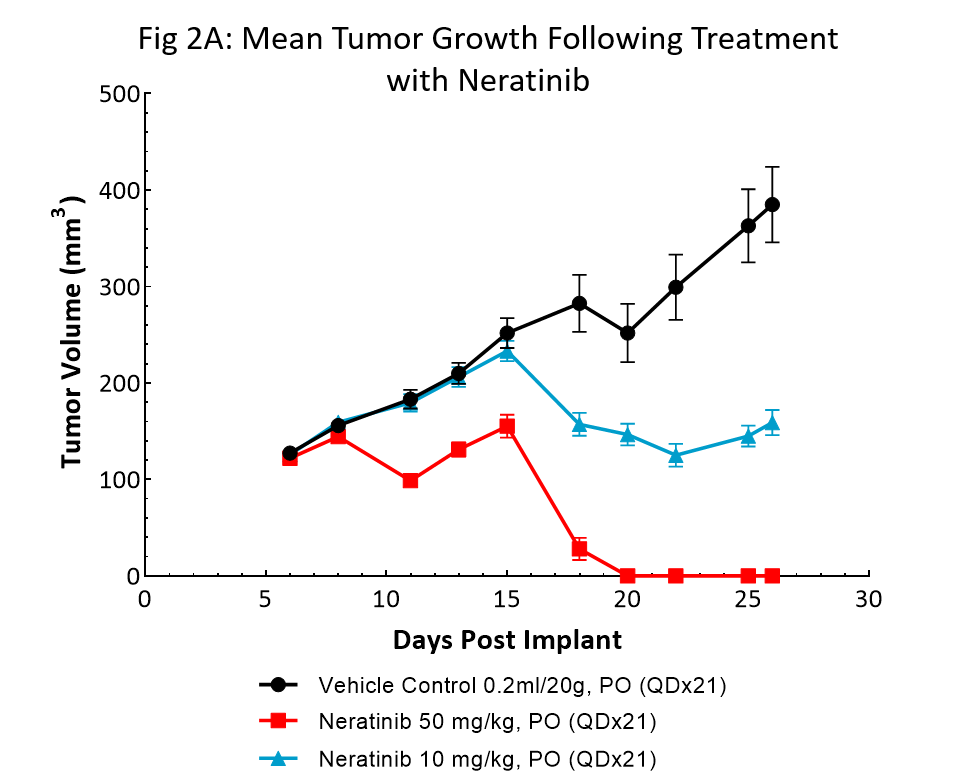
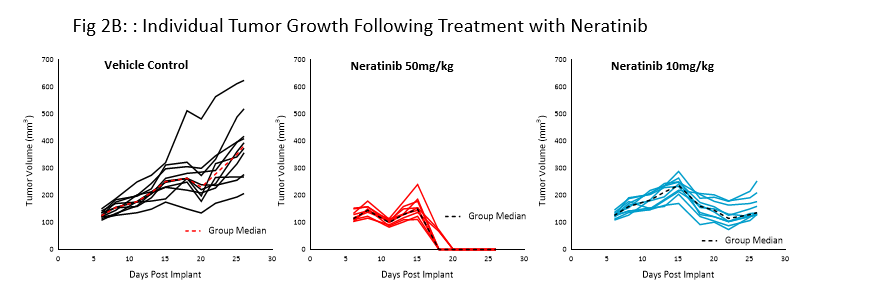
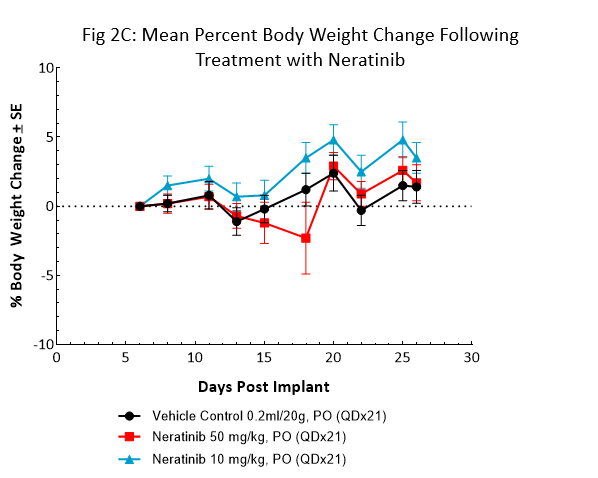
Le nératinib (Nerlynx®) est un inhibiteur irréversible du récepteur de la tyrosine kinase Her2 (récepteur de croissance épidermique humain 2) et EGFR (récepteur du facteur de croissance épidermique), approuvé par la FDA et disponible par voie orale. La réponse au nératinib aux doses de 10 et 50 mg/kg a été évaluée chez des souris NSG porteuses de tumeurs sous-cutanées BT-474 traitées quotidiennement pendant 21 jours consécutifs (fig 2).
Le traitement au nératinib a été bien toléré pour les deux doses, entraînant peu de changement au niveau du poids corporel. Le régime posologique de 50 mg/kg a permis une régression complète de la tumeur chez toutes les souris. Le traitement à la dose la plus faible a entraîné une inhibition de la croissance tumorale de près de 50 %, ce qui laisse supposer une réponse à la dose. Ces données prouvent clairement que le modèle BT-474 a gardé sa surexpression et sa dépendance au récepteur HER2.
BT-474 - Une nouvelle vie pour un outil préclinique puissant
Étant donné le besoin constant de nouveaux traitements ciblés contre le cancer du sein, allant des petites molécules et des anticorps aux thérapies cellulaires, il nous appartient d'optimiser les lignées cellulaires uniques dont nous disposons pour la recherche de nouveaux médicaments.
L'utilisation de modèles comme le BT-474 qui peuvent réduire l'écart entre le modèle préclinique et le patient cancéreux est cruciale. L'optimisation de notre modèle de cancer du sein BT-474 chez les souris NSG a constitué une avancée significative de nos modèles de tumeurs du sein validés, mais nous continuons à évaluer d'autres thérapies ciblées HER2, telles que Herceptin, dans le modèle BT-474.
Please contact us to speak with our scientists about how BT-474 or one of our other models can be used for your next oncology study.
Références
Connexion
Entamons le dialogue
Nous contacter