Date: February 2020
Les souris immunodéficientes souffrent d'un manque d'immunité adaptive. C'est pour cette raison qu'elles sont un hôte idéal pour la transplantation et le développement de cellules tumorales humaines. Les modèles de xénogreffes précliniques utilisant des souris immunodéficientes sont limités quant à l'évaluation d'immunothérapies, et ce, en raison de ce manque de cellules immunitaires fonctionnelles. Cette présentation va mettre en avant une méthode selon laquelle les lymphocytes T humains peuvent se propager chez les souris immunodéprimées et favoriser la croissance de greffe de tumeur.
Des souris NOD-scid IL2Rγnull (NSG) ayant subi une greffe de cellules mononucléaires du sang périphérique humain (hPBMC) ont été utilisées dans des modèles de xénogreffes avec succès pour évaluer l'efficacité et la pharmacodynamique des inhibiteurs des points de contrôle immunitaires ciblant les épitopes des lymphocytes T humains1. Ce modèle est unique par rapport aux xénogreffes conventionnelles, car les cellules T humaines fonctionnelles peuvent cibler des épitopes humains sur une tumeur d'une souris et fournir des données utilisables cliniquement. Les souris NSG n'ont pas assez de populations de cellules dendritiques et macrophages. De plus, elles présentent deux mutations spécifiques, ce qui les rend très déficitaires en lymphocytes ; la mutation Pkrdc désactive certains aspects de la réparation de l'ADN, entraînant la déficience en cellules B et T des souris. Quant à la suppression d'IL2Rγ, cette dernière bloque la maturation des cellules NK2. Cette association de carences rend possible la greffe des hPBMC et la propagation de lymphocytes T humains chez la souris NSG.
La souris NSG ayant subi une greffe de hPBMC présente quelques inconvénients qui doivent être évalués avant la sélection du donneur humain et du modèle tumoral. Tout d'abord, l'administration de cellules immunitaires humaines à une souris entraîne une toxicité provoquée par les cellules T similaire à une réaction du greffon contre l'hôte (GVH), au cours de laquelle les lymphocytes humains attaquent les tissus de la souris, ayant pour effet de limiter la fenêtre thérapeutique3. Deuxièmement, l'efficacité de la greffe, les types de cellules présentes et l'activité ont été observées comme étant variables en fonction des différents donneurs humains4. Enfin, nous avons noté des cas de rejet hPBMC des xénogreffes de tumeurs humaines (données non présentées). L'étude de ces paramètres, le choix du donneur et du modèle de tumeur, avant même de démarrer les études d'efficacité définitives, sont d'une très grande importance pour assurer la réussite des programmes de développement précoce translationnels.
Conception expérimentale
L'objectif de cette étude est d'évaluer la greffe de lymphocytes T humains chez des souris NSG auxquelles des hPBMC ont été administrés et porteuses de xénogreffes de tumeurs humaines sous-cutanées. Le recours aux animaux et leur bien-être sont conformes au Guide du bien-être et du recours aux animaux de laboratoire, dans un centre accrédité par l'AAALAC. Les souris NSG (Laboratoires Jackson, Bar Harbor Maine, États-Unis, souche n° 0005557) porteuses d'adénocarcinomes canalaires du pancréas humain MiaPaCa-2 sous-cutanés ont reçu des hPBMC par voie intraveineuse de quatre donneurs en bonne santé différents (Hemacare, Los Angeles, Californie, États-Unis). Des études sur la croissance tumorale, le poids corporel et l'évaluation de caractéristiques de type GVH ont été réalisées. Le sang total a été collecté en vue d'une analyse de cytométrie en flux des marqueurs de lymphocytes humains pour confirmer la greffe de cellules CD45+ du donneur, y compris des cellules CD4+ et CD8+, les jours 14, 28 et 42 suite à l'administration des hPBMC (Figure 1).
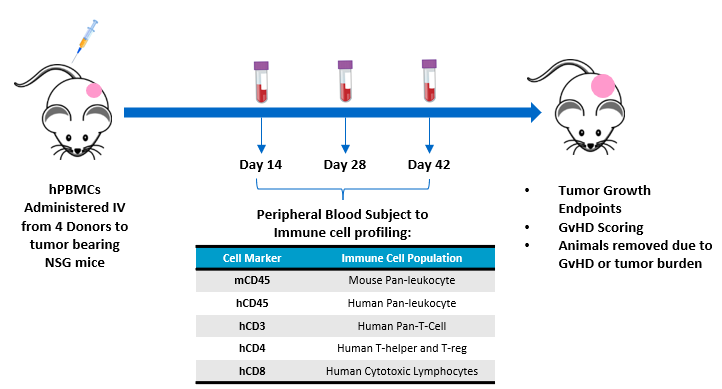
Figure 1 : conception expérimentale évaluant la greffe de hPBMC chez des souris NSG présentant une tumeur MiaPaca-2.
Croissance tumorale, poids corporel et progression de la maladie
Le temps de doublement (Td) de la tumeur MiaPaCa-2 des animaux témoins non traités était de 9,1 jours. Le Td des animaux ayant reçu des hPBMC allait de 8,7 jours à 11,6 jours pour chaque groupe de donneurs. Une variabilité de croissance a été observée chez tous les sujets ayant reçu des hPBMC au-delà de 30 jours suivant l'administration. Il n'y a eu aucune conséquence sur la croissance tumorale avant 1000 mm3 en raison de la greffe des hPBMC (Figure 2). Ces résultats suggèrent que tous les donneurs ayant participé seraient éligibles à des études d'efficacité sur MiaPaCa2, avec un délai d'évaluation (TES) de 1000 mm3.
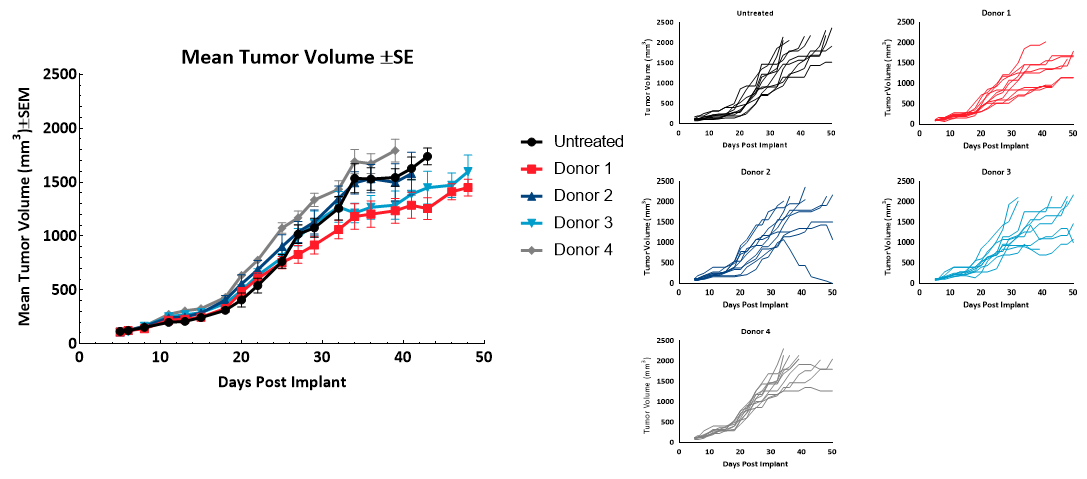
Figure 2 : croissance des tumeurs sous-cutanées MiaPaCa2 (n = 10) suite à l'administration de hPBMC.
L'apparition de symptômes de GVH a été surveillée en se basant sur le poids corporel et des observations cliniques ; bien que ceci n'ait pas été prouvé pathologiquement par cette étude, les symptômes observés dans ce modèle présentent une forte corrélation avec la maladie5. Les symptômes comprennent une perte de poids corporel (Figure 3) supérieure à 10 % du poids de départ, un pelage rugueux, une posture voûtée, des lésions cutanées et une diarrhée. Les animaux présentant tous les symptômes, ou seulement plusieurs symptômes graves, ont été retirés de l'étude. Trente-deux jours suite à l'injection de hPBMC, des signes cliniques ont été observés au moins chez la moitié des animaux de chaque groupe. Les animaux non retirés pour cause de symptômes GVH ont été retirés en raison d'une charge tumorale dépassant 2000 mm3 ou au moment de la fin de l'étude.
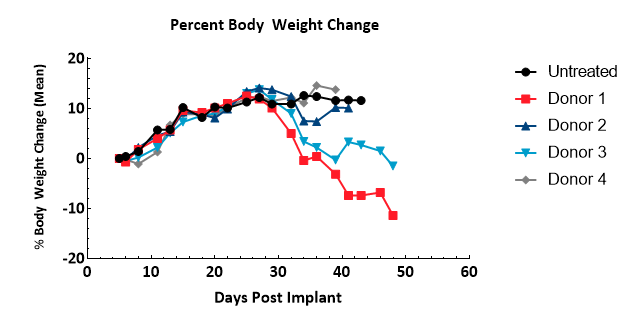
Figure 3 : évaluation de la variation du poids corporel suite à l'administration de hPBMC
Greffe et persistance des lymphocytes humains
La greffe a été mesurée aux jours 14, 28 et 42 suite à l'administration de hPBMC grâce à une analyse immunophénotypique des marqueurs de cellules immunitaires humaines dans le sang périphérique des souris NSG : des mCD45 (pan-leucocytes murins), hCD45 (pan-leucocytes humains), hCD3 (pan-cellules T), hCD4 (lymphocytes T auxiliaires et lymphocytes T régulateurs) et hCD8 (lymphocytes cytotoxiques) ont été détectés par cytométrie en flux (Figure 4).
L'apparition de symptômes de GVH a été surveillée en se basant sur le poids corporel et des observations cliniques ; bien que ceci n'ait pas été prouvé pathologiquement par cette étude, les symptômes observés dans ce modèle présentent une forte corrélation avec la maladie5. Les symptômes comprennent une perte de poids corporel (Figure 3) supérieure à 10 % du poids de départ, un pelage rugueux, une posture voûtée, des lésions cutanées et une diarrhée. Les animaux présentant tous les symptômes, ou seulement plusieurs symptômes graves, ont été retirés de l'étude. Trente-deux jours suite à l'injection de hPBMC, des signes cliniques ont été observés au moins chez la moitié des animaux de chaque groupe. Les animaux non retirés pour cause de symptômes GVH ont été retirés en raison d'une charge tumorale dépassant 2000 mm3 ou au moment de la fin de l'étude.
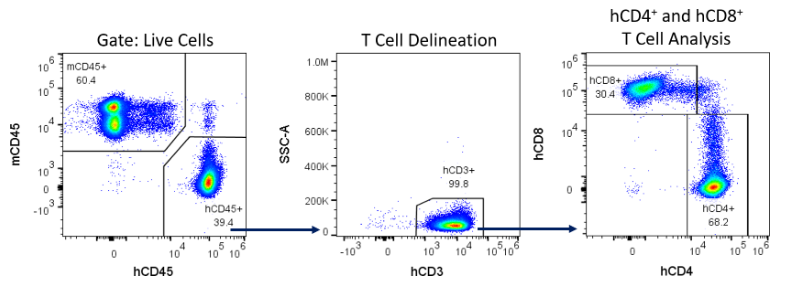
Figure 4 : exemple de stratégie de restriction pour la détection de cellules immunitaires humaines chez les souris NSG reconstituées avec des hPBMC.
Le pourcentage en hCD45+ est calculé comme pourcentage de cellules hCD45+ dans le total des cellules vivantes (basé sur le comptage cellulaire absolu/µL de sang total) et est utilisé comme indicateur de la propagation de la greffe de hPBMC. Nous avons noté que les cellules %hCD45+ dans le sang total étaient détectées, au fil du temps, chez tous les donneurs (Figure 5). Cependant, sur une base individuelle, les donneurs 2 et 4 ont présenté une plus grande augmentation du nombre de cellules hCD45 par rapport aux donneurs 1 et 3, dont la greffe n'était pas si élevée au jour 42 après l'administration de hPBMC. Animals across all groups achieved %hCD45 engraftment levels 28 days post hPBMC administration that is consistent with published literature on the model6.
L'administration de hPBMC à des souris NSG entraîne une persistance des cellules T humaines, avec peu d'effets sur la croissance tumorale de MiaPaCa-2. Ce modèle constitue une plateforme préclinique puissante pour examiner les effets d'agents novateurs qui tirent profit des lymphocytes T humains afin de diriger l'activité antitumorale avec une importance clinique directe. De futurs travaux démontreront l'efficacité d'immunothérapies approuvées par la FDA contre les xénogreffes de tumeurs humaines chez les souris NSG reconstituées avec des hPBMC.
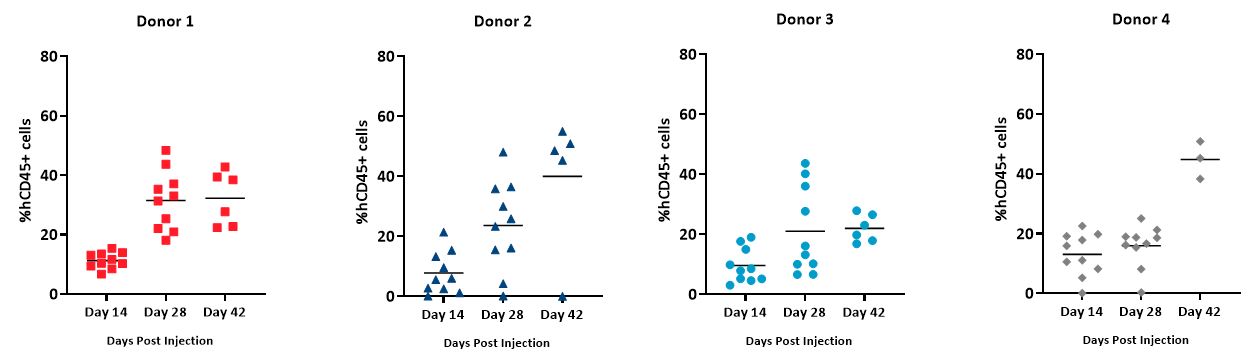
Figure 5 : étendue de la greffe de cellules hCD45+ détectées dans le sang total des souris NSG ayant reçu des hPBMC
Please contact our preclinical oncology scientists to see how hPBMC engrafted NSG mice can be used for your next translational immuno-oncology study.
Références
Connexion
Entamons le dialogue
Nous contacter